研究テーマ Research Subject
今後3年は次のテーマに総力を注ぎます. (2024年4月更新)
・ 糖尿病の移植治療用膵島の高品質化加工【ラット】
過去には以下のテーマにも取り組み, 軌跡を残しました.
・ 精子や体細胞のフリーズドライ保存【ラット・ウシ】
・ 卵子・胚のガラス化【ネコ・ウサギ・ウシ・クジラ】
・ 精子幹細胞やES細胞の樹立と分化誘導【ラット・ウシ】
・ Tg動物と体細胞クローン作製【ラット・ウサギ・ウシ】
・ 顕微授精による胚・産子作製【ラット・ウサギ・ウシ】
・ シルクフィブロイン素材の多目的利用【ラット・ウシ】
博論・修論・卒論タイトル一覧 (1996〜2024) / 直近10年間の発表論文リスト (2016〜2025)

今後3年は次のテーマに総力を注ぎます. (2024年4月更新)
・ 糖尿病の移植治療用膵島の高品質化加工【ラット】
過去には以下のテーマにも取り組み, 軌跡を残しました.
・ 精子や体細胞のフリーズドライ保存【ラット・ウシ】
・ 卵子・胚のガラス化【ネコ・ウサギ・ウシ・クジラ】
・ 精子幹細胞やES細胞の樹立と分化誘導【ラット・ウシ】
・ Tg動物と体細胞クローン作製【ラット・ウサギ・ウシ】
・ 顕微授精による胚・産子作製【ラット・ウサギ・ウシ】
・ シルクフィブロイン素材の多目的利用【ラット・ウシ】
私たちの研究テーマに深く関係する技術・背景について紹介します.
1. 膵島移植による糖尿病治療
糖尿病はインスリン分泌またはインスリン作用の欠陥に起因する高血糖を特徴とする代謝性疾患で, 高血糖が慢性化することで神経や血管に深刻な損傷が引き起こされます. 糖尿病は, 膵β細胞が細胞性自己免疫により破壊されてインスリンの絶対的欠乏が引き起こされて発症する1型 (T1D; 5〜10%) と, インスリン抵抗性と代償性インスリン反応が不十分なことで発症する2型 (T2D; 90〜95%) に大別されます. 我が国は糖尿病患者数が1,100万人 (2021年) と推定されている世界第9位の糖尿病大国ですが, 医学の進歩によってT2D患者は生活習慣の改善 (食事療法や運動療法) と投薬を併用して発症を予防したり, 遅らせたりできるようになっています. 一方, インスリン製剤の自己注射 (強化インスリン療法=対処療法) で血糖値制御することが必須となっているT1D患者には, 単離膵島を門脈からの点滴によって肝臓内に定着させる「膵島移植」という技術の適用が目指されており, このような根治療法は比較的若年齢で発症するT1D患者のQOL改善につながると期待されています. しかしながら, 膵島ドナーの絶対的不足ならびに超急性拒絶による移植膵島の低生着率が, この先端移植医療技術の普及の足かせとなっています.
膵島ドナーの過不足だけでなく, 遠隔地輸送やドナー・レシピエント間の移植適性検査の時間確保といった臨床上の問題点にも対応可能な技術として, 膵島の超低温保存技術がまず上げられます. また, 移植膵島を拒絶反応から守るためのカプセル化剤の設計や, 移植膵島の生着を容易にする徐放性サイトカイン等の同包を可能にするようなスキャホルド (足場) 開発に挑戦する多くの研究者がいます. さらには, 膵島単離工程で起こってしまう機能低下からの回復処理や, サイズが異なる膵島をいったん個々の細胞の懸濁液にしてから移植適正サイズに再構築する「偽膵島化技術」も注目されています.
2. ゲノム編集・臓器再生
DNA配列上の任意の部分を破壊したり, レポーター遺伝子を挿入したりするゲノム編集ツールが近年、急速な発展を遂げています. これまでの「相同遺伝子組み換え」を利用した方法に代わり, 人工ヌクレアーゼ (ZFN及びTALEN) をペアにして使うことで2本鎖DNAを切断し, その修復機構のエラーを利用してゲノム配列を効率的に改変します. ZFNはジンクフィンガーモチーフとよばれるDNA結合ドメインとFokIヌクレアーゼで構成された人工キメラタンパク質であり, 標的DNA配列を認識して切断します. TALENでは, A・C・G・Tそれぞれ1塩基に特異的に対応するユニットからなるTALエフェクターが標的DNA配列を認識します. ZFN, TALENをそれぞれ, 第一世代, 第二世代のゲノム編集技術とするなら, 2013年2月に報告されたRNA誘導型ヌクレアーゼ (CRISPR/Cas9) はさらに進んだ第三世代のゲノム編集技術と言えます. このシステムでは, Cas9タンパク質 (DNA切断酵素) とヒトU6ポリメラーゼIIIプロモーターで発現されたガイドRNAベクターを共発現させ, 標的DNA配列を切断します. CRISPR/Cas法では標的配列に対応するガイドRNAの5’末端の20塩基 (PAMの3塩基を含めると23塩基) を変更するだけで標的遺伝子を変えることができ, 複雑なベクターの構築が必要なZFNやTALENと比較しても迅速・簡便で低コスト, 切断効率が高く, 複数同時処理も可能, という利点を備えています.
最新のゲノム編集ツールを駆使すれば, 比較的短期間のうちに臓器を欠損したモデル動物を作製することも不可能ではありません. 例えば, "FoxN1遺伝子"・"Pdx1遺伝子"・"Sall1遺伝子"の機能を封じ込めることにより, それぞれ"胸腺"・"膵臓"・"腎臓"を欠損したノックアウト (KO) 動物個体を作製できます. 再生医療研究においてES細胞やiPS細胞から複雑な3D構造をとる臓器自体を再生させようとする場合, これらの臓器欠損モデル動物の演じる役割はとても重要になります.
3. 体外受精・顕微授精
卵巣から排卵した第二減数分裂中期の卵子, あるいは体外で成熟させてその発育段階に達した卵子を, 精子と一緒に培養することによって, 新しい生命の第一歩「受精卵 (胚)」を作製することができます. 精子には卵子に侵入させるにあたり "受精能獲得" と呼ばれる生理的かつ機能的な変化を誘起しておく必要があり, 精子が卵子の周りにある卵丘細胞層および透明帯を通過していくときに, その頭部からの酵素放出を伴う "先体反応" という形態的変化を起こします. この体外受精技術は, 1950年代から雄の遺伝資源の有効利用のために実用化された人工授精技術のあとを受け, 1970年代から雌の遺伝資源の有効利用のために急速に普及した受精卵移植技術を基盤として, 雌雄判別, 凍結保存, 双子生産, などの周辺技術の発展とともに改良が加えられてきました.
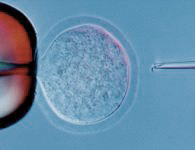
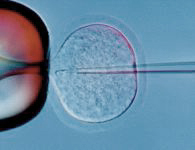
一方, 通常の体外受精によって精子侵入がうまく起こらないケースには, 卵細胞の廻りの透明帯に精子の通り道を開けておく透明帯部分開口術・透明帯と卵細胞の隙間に数個の精子を置く囲卵腔内精子注入法・卵子の中に1個の精子を注入する卵細胞質内精子注入法 (ICSI)・精子に変態する前の円形精子細胞を卵子内に注入する円形精子細胞注入法といった, さらに進んだ生殖補助技術が適用されます. 精子形成時には二倍体の精母細胞が減数分裂して半数体の円形精子細胞になり, その後, 伸長精子細胞を経て頭部・中片部・尾部からなる精子ができますが, 顕微授精卵子の胚発生の引き金をひく活性化因子をもつようになるのは伸長精子細胞以降なので, 円形精子細胞の顕微注入によって授精させた卵子には人為的な活性化処理を施しておく必要があります. これらの顕微授精技術は, ヒトを含む不妊動物の救済法としてのみならず, 受精に関わる諸現象の解明にも大いに貢献しました. 現在ヒトの不妊治療にはICSIまで実用化されており, 体外受精と合わせた "試験管ベイビー" の誕生数は日本で年間約6万人 (全出生数の約1/14; 2019年) にも達しています.
4. 凍結保存・フリーズドライ
生殖細胞 (精子・卵子・胚) を凍結保存することで動物の飼育コストを削減して遺伝資源を半永久的に維持したり, 野生動物の保護といった目的のためにも応用できます. 精子では1952年にグリセリンが凍害保護物質として有効なことが発見されて以来, 人工授精技術の普及が飛躍的に進みました. また胚では, 細胞を緩慢に冷却して十分に脱水させることで蘇生例が得られるということが1972年に報告され, 技術改良を経て受精卵移植や体外受精の展開にとって不可欠な技術になり,「二段階凍結法」という形で今も広く普及しています. しかし動物種や胚の発育段階, 胚の作製方法によって最適な凍結保存条件が大きく異なっていることもわかってきました. 一方1985年には, 室温で脱水させて-196℃の液体窒素中に投入する超急速凍結法 (氷晶が小さくて固化した溶液が透き通って見えることから「ガラス化保存法」と呼ばれる) が開発され, 保存行程に要する時間が大幅に短縮されました. 冷却速度をさらに高速化したその改良法は胚だけでなく未受精卵の保存にも有効なことが報告され, デバイスの改良も伴って現在, ヒト未受精卵の超低温保存法として普及するに至っています. しかし卵細胞質脂肪顆粒が多いウシやブタの未受精卵で実用化を目指すには, まだ改良の余地が残されています.
1998年, フリーズドライ処理したマウス精子をICSIすることによって正常な産子が生まれることが報告されました. −196℃の液体窒素を使うことなく生殖細胞や二倍体体細胞を常温あるいは冷蔵庫で長期間保存できるようになれば, 保存コスト (液体窒素のKg単価はガソリン以上に高く, 保存タンク中でも気化してしまうので定期的な補充が必要) の大幅な削減につながるばかりでなく, 貴重な細胞サンプルをエアメールの封筒に入れて大陸間輸送することだって可能になります.
5. 形質転換・クローン
動物個体レベルでの遺伝子の改変は, 外来遺伝子溶液を受精卵の雄性前核に顕微注入してゲノム上に新しい遺伝子配列を付加したり (トランスジェニック動物), 胚性幹細胞 (ES細胞) のような培養細胞を用いて相同遺伝子組み換えによって標的遺伝子を破壊し, キメラを作製してからその次の世代からES細胞由来の個体を得る (ノックアウト動物), という方法で成し遂げられます. 前者のトランスジェニック動物の場合, 1980年以降, ほとんどの動物種で前核期受精卵への外来DNA溶液の顕微注入によって作製できることが証明されており, 顕微授精を介した方法でもトランスジェニック動物が作製できると報告されています. 後者のノックアウト動物を作製する場合にはES細胞株が利用可能なことが重要ですが, 実験動物ではごく最近までマウスでしかその細胞株はなく, ラットでES細胞株が樹立されたのは2008年の年末になってからのことです. もっとも2006年, Oct3/4・c-myc・Sox2・klf4の導入によって分化した体細胞から誘導多能性幹細胞 (iPS細胞) が樹立できるという京都大学 山中教授らの画期的発見により, 様々な動物種でノックアウト動物作製の可能性が言われてはいましたが... この研究領域からは最近, マウスのES細胞から精子 (2011年8月) が, iPS細胞から卵子 (2012年10月) が作り出され, 子供まで誕生したというニュースも飛び込んできました.
「体細胞核移植技術」を使って1997年にクローンヒツジ "ドリー" が誕生したというニュースは大きくマスメディアで取り上げられ, トランスジェニック動物やノックアウト動物を作るためにESやiPSのような幹細胞でなくても通常の培養細胞も利用できるようになりました. 体細胞核由来のクローン個体誕生のニュースは, ヒツジの他, マウス・ウシ・ヤギ・ブタ・ネコ・イヌ・ウマでも聞かれるようになりました. しかし, 脳機能解析に最適の実験小動物であるラットと心臓疾患の研究に適したウサギでは, まだ再現性あるクローン個体作製技術は確立されていません.

1. 膵島移植による糖尿病治療
糖尿病はインスリン分泌またはインスリン作用の欠陥に起因する高血糖を特徴とする代謝性疾患で, 高血糖が慢性化することで神経や血管に深刻な損傷が引き起こされます. 糖尿病は, 膵β細胞が細胞性自己免疫により破壊されてインスリンの絶対的欠乏が引き起こされて発症する1型 (T1D; 5〜10%) と, インスリン抵抗性と代償性インスリン反応が不十分なことで発症する2型 (T2D; 90〜95%) に大別されます. 我が国は糖尿病患者数が1,100万人 (2021年) と推定されている世界第9位の糖尿病大国ですが, 医学の進歩によってT2D患者は生活習慣の改善 (食事療法や運動療法) と投薬を併用して発症を予防したり, 遅らせたりできるようになっています. 一方, インスリン製剤の自己注射 (強化インスリン療法=対処療法) で血糖値制御することが必須となっているT1D患者には, 単離膵島を門脈からの点滴によって肝臓内に定着させる「膵島移植」という技術の適用が目指されており, このような根治療法は比較的若年齢で発症するT1D患者のQOL改善につながると期待されています. しかしながら, 膵島ドナーの絶対的不足ならびに超急性拒絶による移植膵島の低生着率が, この先端移植医療技術の普及の足かせとなっています.
膵島ドナーの過不足だけでなく, 遠隔地輸送やドナー・レシピエント間の移植適性検査の時間確保といった臨床上の問題点にも対応可能な技術として, 膵島の超低温保存技術がまず上げられます. また, 移植膵島を拒絶反応から守るためのカプセル化剤の設計や, 移植膵島の生着を容易にする徐放性サイトカイン等の同包を可能にするようなスキャホルド (足場) 開発に挑戦する多くの研究者がいます. さらには, 膵島単離工程で起こってしまう機能低下からの回復処理や, サイズが異なる膵島をいったん個々の細胞の懸濁液にしてから移植適正サイズに再構築する「偽膵島化技術」も注目されています.



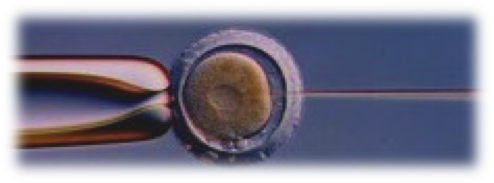
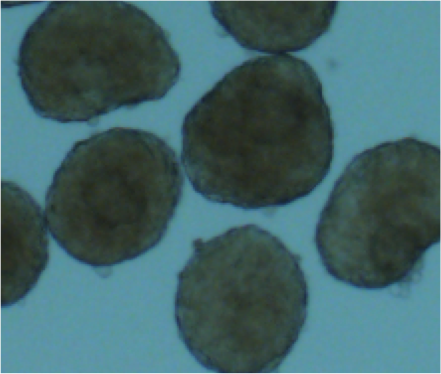
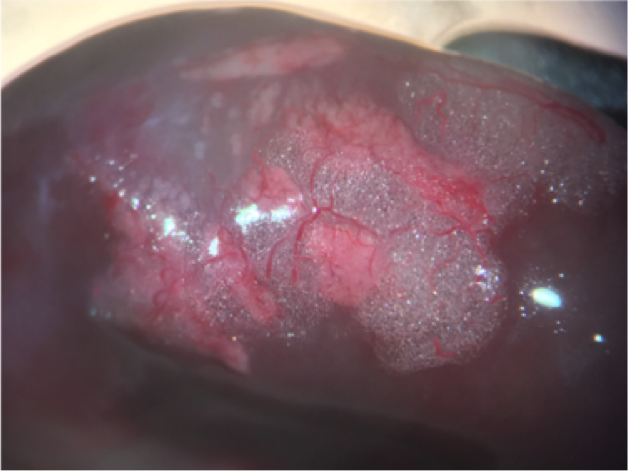
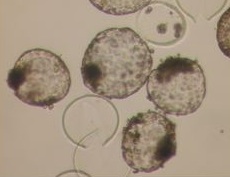
写真左: ラット胆管から膵臓への酵素溶液注入操作. 写真中央: 単離した膵ランゲルハンス島 (外径 約200-µm). 写真右: 腎臓被膜下への移植後に生着・機能した膵ランゲルハンス島.
2. ゲノム編集・臓器再生
DNA配列上の任意の部分を破壊したり, レポーター遺伝子を挿入したりするゲノム編集ツールが近年、急速な発展を遂げています. これまでの「相同遺伝子組み換え」を利用した方法に代わり, 人工ヌクレアーゼ (ZFN及びTALEN) をペアにして使うことで2本鎖DNAを切断し, その修復機構のエラーを利用してゲノム配列を効率的に改変します. ZFNはジンクフィンガーモチーフとよばれるDNA結合ドメインとFokIヌクレアーゼで構成された人工キメラタンパク質であり, 標的DNA配列を認識して切断します. TALENでは, A・C・G・Tそれぞれ1塩基に特異的に対応するユニットからなるTALエフェクターが標的DNA配列を認識します. ZFN, TALENをそれぞれ, 第一世代, 第二世代のゲノム編集技術とするなら, 2013年2月に報告されたRNA誘導型ヌクレアーゼ (CRISPR/Cas9) はさらに進んだ第三世代のゲノム編集技術と言えます. このシステムでは, Cas9タンパク質 (DNA切断酵素) とヒトU6ポリメラーゼIIIプロモーターで発現されたガイドRNAベクターを共発現させ, 標的DNA配列を切断します. CRISPR/Cas法では標的配列に対応するガイドRNAの5’末端の20塩基 (PAMの3塩基を含めると23塩基) を変更するだけで標的遺伝子を変えることができ, 複雑なベクターの構築が必要なZFNやTALENと比較しても迅速・簡便で低コスト, 切断効率が高く, 複数同時処理も可能, という利点を備えています.
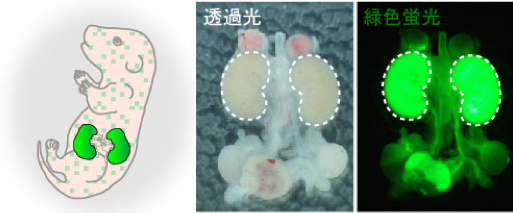
最新のゲノム編集ツールを駆使すれば, 比較的短期間のうちに臓器を欠損したモデル動物を作製することも不可能ではありません. 例えば, "FoxN1遺伝子"・"Pdx1遺伝子"・"Sall1遺伝子"の機能を封じ込めることにより, それぞれ"胸腺"・"膵臓"・"腎臓"を欠損したノックアウト (KO) 動物個体を作製できます. 再生医療研究においてES細胞やiPS細胞から複雑な3D構造をとる臓器自体を再生させようとする場合, これらの臓器欠損モデル動物の演じる役割はとても重要になります.

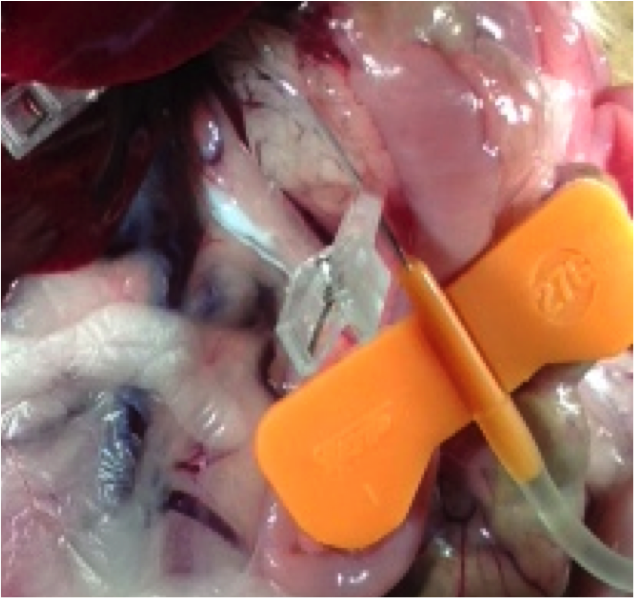
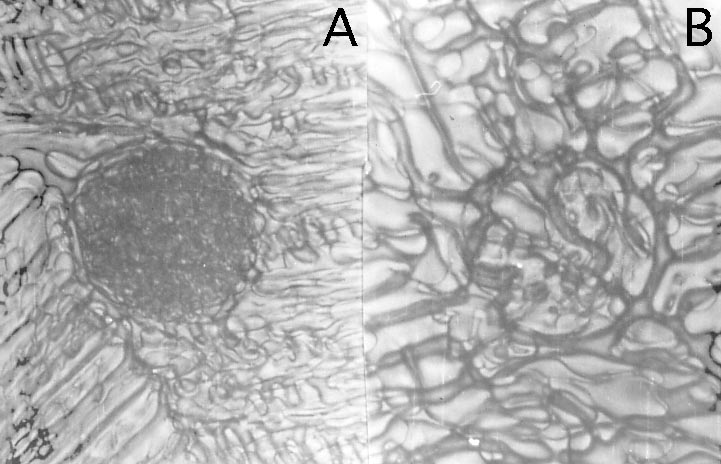
写真: Sall1 KOラット由来の胚盤胞にGFPマウス由来ES細胞を注入し, 誕生した異種キメララット体内に再生されたマウス腎.
3. 体外受精・顕微授精
卵巣から排卵した第二減数分裂中期の卵子, あるいは体外で成熟させてその発育段階に達した卵子を, 精子と一緒に培養することによって, 新しい生命の第一歩「受精卵 (胚)」を作製することができます. 精子には卵子に侵入させるにあたり "受精能獲得" と呼ばれる生理的かつ機能的な変化を誘起しておく必要があり, 精子が卵子の周りにある卵丘細胞層および透明帯を通過していくときに, その頭部からの酵素放出を伴う "先体反応" という形態的変化を起こします. この体外受精技術は, 1950年代から雄の遺伝資源の有効利用のために実用化された人工授精技術のあとを受け, 1970年代から雌の遺伝資源の有効利用のために急速に普及した受精卵移植技術を基盤として, 雌雄判別, 凍結保存, 双子生産, などの周辺技術の発展とともに改良が加えられてきました.
一方, 通常の体外受精によって精子侵入がうまく起こらないケースには, 卵細胞の廻りの透明帯に精子の通り道を開けておく透明帯部分開口術・透明帯と卵細胞の隙間に数個の精子を置く囲卵腔内精子注入法・卵子の中に1個の精子を注入する卵細胞質内精子注入法 (ICSI)・精子に変態する前の円形精子細胞を卵子内に注入する円形精子細胞注入法といった, さらに進んだ生殖補助技術が適用されます. 精子形成時には二倍体の精母細胞が減数分裂して半数体の円形精子細胞になり, その後, 伸長精子細胞を経て頭部・中片部・尾部からなる精子ができますが, 顕微授精卵子の胚発生の引き金をひく活性化因子をもつようになるのは伸長精子細胞以降なので, 円形精子細胞の顕微注入によって授精させた卵子には人為的な活性化処理を施しておく必要があります. これらの顕微授精技術は, ヒトを含む不妊動物の救済法としてのみならず, 受精に関わる諸現象の解明にも大いに貢献しました. 現在ヒトの不妊治療にはICSIまで実用化されており, 体外受精と合わせた "試験管ベイビー" の誕生数は日本で年間約6万人 (全出生数の約1/14; 2019年) にも達しています.



写真左: 釣り針型をしたラット精子頭部の卵子内への顕微注入操作. ガラス管内に精子頭部を完全吸引せず, 膜穿孔と同時に打ち込むような注入法を採用. 写真右: ウシ顕微授精卵子内に形成された微小管形成中心由来の精子星状体 (6時方向).
4. 凍結保存・フリーズドライ
生殖細胞 (精子・卵子・胚) を凍結保存することで動物の飼育コストを削減して遺伝資源を半永久的に維持したり, 野生動物の保護といった目的のためにも応用できます. 精子では1952年にグリセリンが凍害保護物質として有効なことが発見されて以来, 人工授精技術の普及が飛躍的に進みました. また胚では, 細胞を緩慢に冷却して十分に脱水させることで蘇生例が得られるということが1972年に報告され, 技術改良を経て受精卵移植や体外受精の展開にとって不可欠な技術になり,「二段階凍結法」という形で今も広く普及しています. しかし動物種や胚の発育段階, 胚の作製方法によって最適な凍結保存条件が大きく異なっていることもわかってきました. 一方1985年には, 室温で脱水させて-196℃の液体窒素中に投入する超急速凍結法 (氷晶が小さくて固化した溶液が透き通って見えることから「ガラス化保存法」と呼ばれる) が開発され, 保存行程に要する時間が大幅に短縮されました. 冷却速度をさらに高速化したその改良法は胚だけでなく未受精卵の保存にも有効なことが報告され, デバイスの改良も伴って現在, ヒト未受精卵の超低温保存法として普及するに至っています. しかし卵細胞質脂肪顆粒が多いウシやブタの未受精卵で実用化を目指すには, まだ改良の余地が残されています.
1998年, フリーズドライ処理したマウス精子をICSIすることによって正常な産子が生まれることが報告されました. −196℃の液体窒素を使うことなく生殖細胞や二倍体体細胞を常温あるいは冷蔵庫で長期間保存できるようになれば, 保存コスト (液体窒素のKg単価はガソリン以上に高く, 保存タンク中でも気化してしまうので定期的な補充が必要) の大幅な削減につながるばかりでなく, 貴重な細胞サンプルをエアメールの封筒に入れて大陸間輸送することだって可能になります.


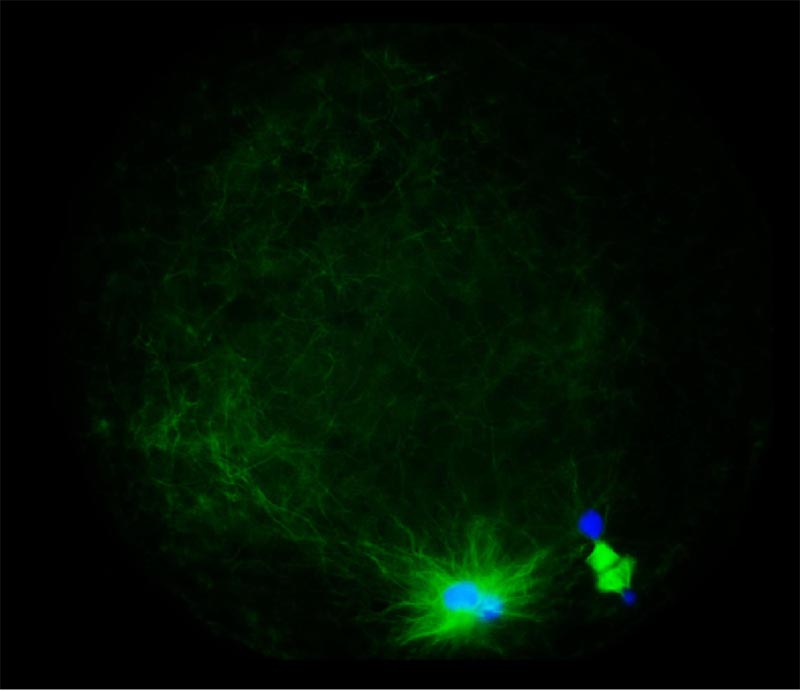
写真左: ガラス化保存後に蘇生・孵化した顕微授精由来ウシ胚盤胞. 写真右: (A) 冷却過程で細胞内凍結によって死滅したマウス卵子. (B) 脱水・収縮しながらも生存しているマウス卵子.
5. 形質転換・クローン
動物個体レベルでの遺伝子の改変は, 外来遺伝子溶液を受精卵の雄性前核に顕微注入してゲノム上に新しい遺伝子配列を付加したり (トランスジェニック動物), 胚性幹細胞 (ES細胞) のような培養細胞を用いて相同遺伝子組み換えによって標的遺伝子を破壊し, キメラを作製してからその次の世代からES細胞由来の個体を得る (ノックアウト動物), という方法で成し遂げられます. 前者のトランスジェニック動物の場合, 1980年以降, ほとんどの動物種で前核期受精卵への外来DNA溶液の顕微注入によって作製できることが証明されており, 顕微授精を介した方法でもトランスジェニック動物が作製できると報告されています. 後者のノックアウト動物を作製する場合にはES細胞株が利用可能なことが重要ですが, 実験動物ではごく最近までマウスでしかその細胞株はなく, ラットでES細胞株が樹立されたのは2008年の年末になってからのことです. もっとも2006年, Oct3/4・c-myc・Sox2・klf4の導入によって分化した体細胞から誘導多能性幹細胞 (iPS細胞) が樹立できるという京都大学 山中教授らの画期的発見により, 様々な動物種でノックアウト動物作製の可能性が言われてはいましたが... この研究領域からは最近, マウスのES細胞から精子 (2011年8月) が, iPS細胞から卵子 (2012年10月) が作り出され, 子供まで誕生したというニュースも飛び込んできました.
「体細胞核移植技術」を使って1997年にクローンヒツジ "ドリー" が誕生したというニュースは大きくマスメディアで取り上げられ, トランスジェニック動物やノックアウト動物を作るためにESやiPSのような幹細胞でなくても通常の培養細胞も利用できるようになりました. 体細胞核由来のクローン個体誕生のニュースは, ヒツジの他, マウス・ウシ・ヤギ・ブタ・ネコ・イヌ・ウマでも聞かれるようになりました. しかし, 脳機能解析に最適の実験小動物であるラットと心臓疾患の研究に適したウサギでは, まだ再現性あるクローン個体作製技術は確立されていません.



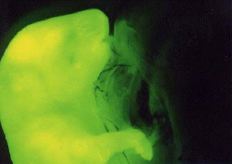
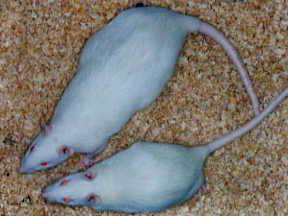
写真左: ラット体細胞核と除核未受精卵との電気融合. 写真中央: クラゲ由来緑色蛍光タンパク質 (GFP) 遺伝子を発現している "光る" ラット. 写真右: ヒト成長ホルモン遺伝子を発現し, 巨大化したラットとその姉妹.