C-配糖体とは
C-配糖体は、フラボンやカルコンなどの化合物に対し、糖が炭素−炭素結合した化合物群です。この特殊な結合のため、O-配糖体などの他の配糖体と比較すると糖の結合が化学的に安定で、グリコシダーゼや酸による加水分解を受けないという特徴を持っています。
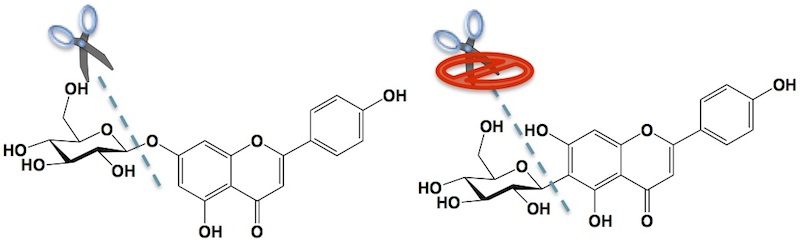
C-配糖体は切れにくい。
(左)O-配糖体(アピゲニン-7-O-グルコシド)、(右)C-配糖体(イソビテキシン)
植物には種々のC-配糖体が存在することが報告されています。その中で最も一般的なフラボノイドC-配糖体は、抗菌・抗酸化物質、昆虫の摂食阻害物質や花の助色素などとしての作用のほか、動物に対して、血圧降下、抗炎症、抗肥満など、様々な生理活性を示すことが報告されている有用な化合物です。また、結合糖としては、グルコース以外にアラビノースやキシロースなど植物由来の他の低分子配糖体ではまれな糖が結合したものや、複数の糖が結合したものなど、興味深い化合物が存在しています。しかし、植物のC−配糖体生合成に関わるC-配糖化酵素は、まだ数種類の遺伝子が同定されただけでの状況で、植物由来の他の配糖化酵素と比べるとほとんど研究が進んでいません。
私たちの研究室では、この独特な結合を作り出すC-配糖化酵素の解析を進めるとともに、それらを利用した有用物質の生産を目指した研究を行っています。
ソバのC-配糖化酵素(FeCGT)の解析
 ソバは、フラボノイドC-配糖体を子葉に特異的に蓄積します。そこで、私たちは、ソバの子葉からフラボノイドC-配糖化酵素の精製を行って、断片化したペプチドのアミノ酸配列の推定を行い、この酵素をコードする遺伝子(FeCGTa FeCGTb)の単離を行いました。さらに、これらを大腸菌で異種宿主発現させた酵素の反応性を解析し、2−ヒドロキシフラバノンの開環構造に対して反応することを示しました。この成果は、発表時、双子葉植物では初のC-配糖化酵素の遺伝子同定の報告でした。(Nagatomo et al. 2014)
ソバは、フラボノイドC-配糖体を子葉に特異的に蓄積します。そこで、私たちは、ソバの子葉からフラボノイドC-配糖化酵素の精製を行って、断片化したペプチドのアミノ酸配列の推定を行い、この酵素をコードする遺伝子(FeCGTa FeCGTb)の単離を行いました。さらに、これらを大腸菌で異種宿主発現させた酵素の反応性を解析し、2−ヒドロキシフラバノンの開環構造に対して反応することを示しました。この成果は、発表時、双子葉植物では初のC-配糖化酵素の遺伝子同定の報告でした。(Nagatomo et al. 2014)
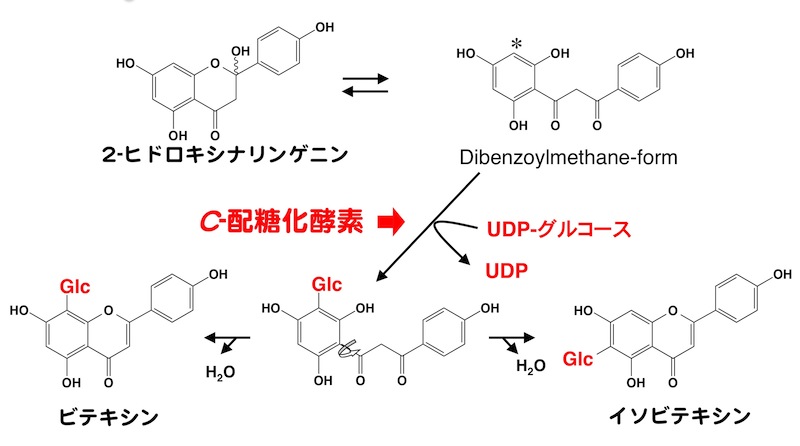
ソバにおけるC-配糖体の生合成
ソバのC-配糖化酵素を発現させた大腸菌によるC-配糖体の生産
配糖化酵素を発現させた微生物による物質生産や物質変換は、希少な有用化合没を効率的に生産させる可能性が見込まれることから、近年、注目されています。
私たちは、ソバのC-配糖化酵素(FeCGTa)を発現させた大腸菌を利用したC-配糖体生産系の確立を目指しました。
FeCGTaタンパク質を発現誘導した大腸菌を回収し、グルコースを含む培地に移したのちに、FeCGTaの基質となるフラボノイド関連化合物を投与しました。その結果、これらは効率的にC-配糖体に変換され、さらに培地中から回収することができました(図)。例えば、フラボノイドの一種であるフロレチン102mgを、上記の200mLの培養系に12時間かけて逐次投与したところ、90%以上の変換率で変換されました。その後の精製過程を経て、最終的に110mgのノソファジン(収率67%)を得ることができました。(Ito et al. 2014)
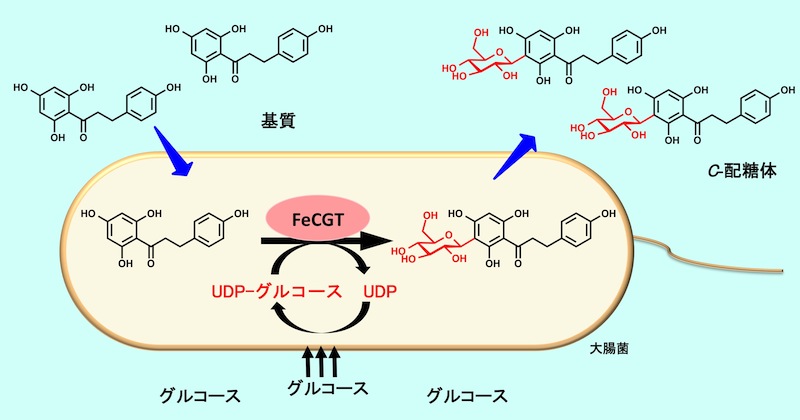
C-配糖化酵素を発現させた大腸菌を用いたC-配糖体への変換系
カンキツ類のdi-C-配糖化酵素の解析
 カンキツ類は健康増進効果が期待されているフラボノイドdi-C-配糖体を蓄積します。しかし、その生合成酵素はこれまで分子レベルでは明らかにされていませんでした。私たちは、ソバのC−配糖化酵素の情報を元にカンキツ類のデータベースを探索して遺伝子クローニングを行い、フラボノイドdi-C-配糖体生合成を担う「C-配糖化酵素」をキンカン(写真)とミカンから初めて同定(FcCGTとCuCGT)しました。異種宿主発現させた酵素を用いて酵素反応性の解析を行った結果、これらカンキツ類では、生合成において、1つのC-配糖化酵素によりフラボノイド1分子に2分子の糖が転移されることを明らかにしました。さらに、この酵素を発現させた大腸菌を利用して、フラボノイドdi-C-配糖体を生産する系を確立しました。(Ito et al. 2017)
カンキツ類は健康増進効果が期待されているフラボノイドdi-C-配糖体を蓄積します。しかし、その生合成酵素はこれまで分子レベルでは明らかにされていませんでした。私たちは、ソバのC−配糖化酵素の情報を元にカンキツ類のデータベースを探索して遺伝子クローニングを行い、フラボノイドdi-C-配糖体生合成を担う「C-配糖化酵素」をキンカン(写真)とミカンから初めて同定(FcCGTとCuCGT)しました。異種宿主発現させた酵素を用いて酵素反応性の解析を行った結果、これらカンキツ類では、生合成において、1つのC-配糖化酵素によりフラボノイド1分子に2分子の糖が転移されることを明らかにしました。さらに、この酵素を発現させた大腸菌を利用して、フラボノイドdi-C-配糖体を生産する系を確立しました。(Ito et al. 2017)
キンカンの花(左)と果実(右)
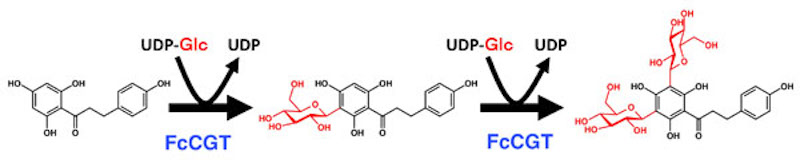
カンキツ類におけるC-配糖体の生合成。同じ酵素が2回触媒する。
(図は、キンカンにおけるフロレチンの配糖化の例)
これからも、いろいろな植物からC-配糖化酵素の単離・解析や、結晶構造解析やアミノ酸点突然変異導入した酵素の解析などを行って、C-配糖化酵素の反応機構、(この酵素がどのようにしてこの特殊な「炭素−炭素」結合を作り出すのか)、を明らかにしたいと考えています。
[関連論文等]
- Ito, T., Fujimoto, F., Suito, F., Shimosaka, M., Taguchi, G. (2017) C-Glycosyltransferases catalyzing the formation of di-C-glucosyl flavonoids in citrus plants. Plant J. 91(2), 187-198.
- Taguchi, G. (2016) Flavonoid Biosynthesis in Buckwheat. In, Zhou et al. eds, Molecular Breeding and Nutritional Aspects of Buckwheat, Academic Press (Elsevier), pp.377-386.
- 田口悟朗 (2015) 、バイオサイエンスとインダストリー, 69, 215-217.
- 田口悟朗 (2015) 切れない糖修飾を作る酵素. 生物工学会誌 93(1), 36.
- Ito, T., Fujimoto, S., Shimosaka, M., Taguchi, G. (2014) Production of C-glucosides of flavonoids and related compounds by Escherichia coli expressing buckwheat C-glucosyltransferase. Plant Biotechnol., 31, 519-524.
- Nagatomo, Y., Usui, S., Ito, T., Kato, A., Shimosaka, M., Taguchi, G. (2014) Purification, molecular cloning and functional characterization of flavonoid C-glucosyltransferases from Fagopyrum esculentum M. (buckwheat) cotyledon. Plant J., 80, 437-448.
11th Jul. 2017 更新

 ソバは、フラボノイドC-配糖体を子葉に特異的に蓄積します。そこで、私たちは、ソバの子葉からフラボノイドC-配糖化酵素の精製を行って、断片化したペプチドのアミノ酸配列の推定を行い、この酵素をコードする遺伝子(FeCGTa FeCGTb)の単離を行いました。さらに、これらを大腸菌で異種宿主発現させた酵素の反応性を解析し、2−ヒドロキシフラバノンの開環構造に対して反応することを示しました。この成果は、発表時、双子葉植物では初のC-配糖化酵素の遺伝子同定の報告でした。(Nagatomo et al. 2014)
ソバは、フラボノイドC-配糖体を子葉に特異的に蓄積します。そこで、私たちは、ソバの子葉からフラボノイドC-配糖化酵素の精製を行って、断片化したペプチドのアミノ酸配列の推定を行い、この酵素をコードする遺伝子(FeCGTa FeCGTb)の単離を行いました。さらに、これらを大腸菌で異種宿主発現させた酵素の反応性を解析し、2−ヒドロキシフラバノンの開環構造に対して反応することを示しました。この成果は、発表時、双子葉植物では初のC-配糖化酵素の遺伝子同定の報告でした。(Nagatomo et al. 2014) 

 カンキツ類は健康増進効果が期待されているフラボノイドdi-C-配糖体を蓄積します。しかし、その生合成酵素はこれまで分子レベルでは明らかにされていませんでした。私たちは、ソバのC−配糖化酵素の情報を元にカンキツ類のデータベースを探索して遺伝子クローニングを行い、フラボノイドdi-C-配糖体生合成を担う「C-配糖化酵素」をキンカン(写真)とミカンから初めて同定(FcCGTとCuCGT)しました。異種宿主発現させた酵素を用いて酵素反応性の解析を行った結果、これらカンキツ類では、生合成において、1つのC-配糖化酵素によりフラボノイド1分子に2分子の糖が転移されることを明らかにしました。さらに、この酵素を発現させた大腸菌を利用して、フラボノイドdi-C-配糖体を生産する系を確立しました。(Ito et al. 2017)
カンキツ類は健康増進効果が期待されているフラボノイドdi-C-配糖体を蓄積します。しかし、その生合成酵素はこれまで分子レベルでは明らかにされていませんでした。私たちは、ソバのC−配糖化酵素の情報を元にカンキツ類のデータベースを探索して遺伝子クローニングを行い、フラボノイドdi-C-配糖体生合成を担う「C-配糖化酵素」をキンカン(写真)とミカンから初めて同定(FcCGTとCuCGT)しました。異種宿主発現させた酵素を用いて酵素反応性の解析を行った結果、これらカンキツ類では、生合成において、1つのC-配糖化酵素によりフラボノイド1分子に2分子の糖が転移されることを明らかにしました。さらに、この酵素を発現させた大腸菌を利用して、フラボノイドdi-C-配糖体を生産する系を確立しました。(Ito et al. 2017)